Équipe
Toxoplasmose & Hôte-parasite coevolution
Dpt: Environnement, Reproduction, Infections, Cancer
Nos activités de recherche
La toxoplasmose est une zoonose cosmopolite bénigne chez les sujets immunocompétents, mais responsable d’infections congénitales et opportunistes (SIDA) potentiellement sévères. Toxoplasma est un parasite intracellulaire obligatoire qui déploie des mécanismes sophistiqués pour prendre le contrôle de sa cellule hôte. Il injecte ainsi des protéines effectrices qui viendront par mimétisme moléculaire altérer l’expression du génome de la cellule infectée. Notre équipe étudie les dialogues et les conflits moléculaires entre le parasite et ses hôtes qui ont permis au cours de l’évolution sa persistance et sa transmission dans une multitude d’hôtes. Notre équipe s’intéresse aussi au cycle de vie hétéroxène de Toxoplasma à la recherche des interrupteurs moléculaires qui contrôlent la dormance et la transmission entre hôtes des stades spécialisés. Nous avons attribué un rôle majeur aux mécanismes épigénétiques dans le passage d’un stade à un autre ou dans le maintien dans un stade donné. Nous étudions les étapes et les acteurs moléculaires qui contrôlent le développement sexuel avec l’objectif ambitieux de développer un protocole de conversion in vitro des stades sexués, à ce jour peu étudiés, car leur genèse n’est possible que chez le chat. Notre équipe a aussi une valence appliquée très forte avec la recherche de marqueurs sérologiques pour la toxoplasmose chronique et de nouvelles options thérapeutiques pour la toxoplasmose, la cryptosporidiose et la malaria.
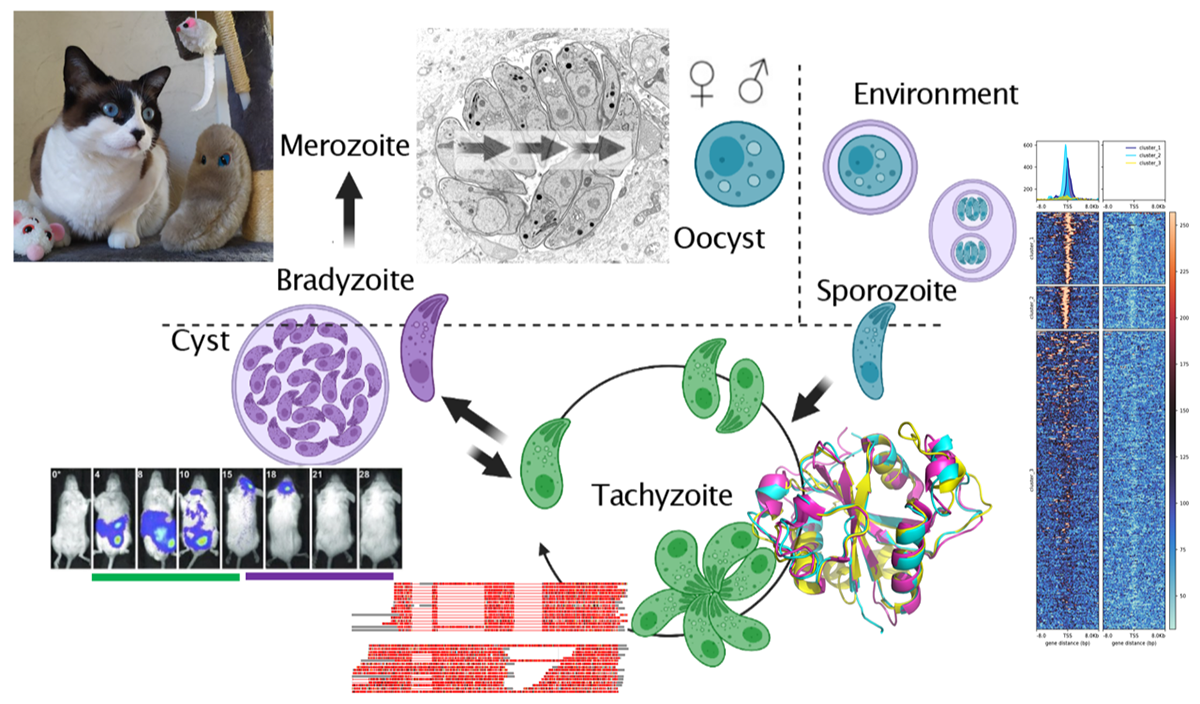
Nos axes de recherche
Toxoplasma détourne activement les voies de signalisation de l'hôte de leurs fonctions d'origine pour favoriser sa persistance et sa transmission à une multitude d’hôtes. L’équipe explore comment le parasite altère épigénétiquement l'expression des gènes de la cellule hôte en y injectant des protéines effectrices. La survie et la chronicité du parasite serait ainsi favorisée par une évolution adaptative accélérée des protéines effectrices qui limitent la réponse immunitaire.
En savoir plusTous les stades de développement de Toxoplasma ont leur propre signature transcriptionnelle, et le passage d'un stade à l'autre est contrôlé par des cascades de régulation où les mécanismes épigénétiques covalents et non covalents agissent comme des forces motrices. Cet axe de recherche explore ces contributions épigénétiques à l’expression du génome parasitaire qui guident les transitions vers la chronicité et le développement sexuel, voire fixent le zoïte dans un état différencié donné.
En savoir plusLes Apicomplexa sont responsables de maladies infectieuses humaines majeures comme la toxoplasmose ou la malaria mais les traitements actuels sont sous-optimaux et peu d'alternatives existent. Pour réduire le délai de développement et les coûts des essais cliniques, nous avons adopté une stratégie de repositionnement pour identifier des nouveaux candidats-médicaments antiparasitaires. Pour chaque molécule d’intérêt, nous cherchons à identifier sa protéine cible et son mode d’action.
En savoir plusLa sérologie est un élément clé du diagnostic de la toxoplasmose mais les tests actuels ne font pas toujours la distinction entre les états pathologiques aigües, latents et réactivés. Nous avons identifié des marqueurs sérologiques spécifiques des kystes tissulaires/bradyzoïtes qui permettent le diagnostic en modèle murin d’une infection latente avec portabilité de kystes cérébraux. Notre objectif est maintenant l’optimisation de ces marqueurs pour des applications en médecine humaine.
En savoir plusNos publications majeures
Voir toutes les publicationsNos activités en images
Nos collaborations
- Matthew Bowler (EMBL-Grenoble outstation, France)
- Amit Sharma (ICGEB, New Delhi, India)
- Jeroen Saeij (UC Davis, USA)
- Isabelle Coppens (Johns Hopkins University, Baltimore, USA)
- L. David Sibley (Washington University School of Medicine, St. Louis, USA)
- Dominique Soldati-Favre (Geneva university, Switzerland)
- Antonio Barragan (Stockholm University, Stockholm, Sweden)
- Fabrice Laurent (INRAe, Tours, France)
- Artur Scherf (Pasteur Institute, Paris, France)
- Thierry Lagrange (CNRS, Perpignan, France)
- Isabelle Tardieux (CNRS, Grenoble, France)
Nos technologies
- Cell culture and gene editing (CRISPR-Cas9) in Toxoplasma gondii
- Cell biology (epifluorescence, confocal)
- Gene expression analyses (Illumina, Nanopore DRS, qRT-PCR)
- Epigenetic analysis (ChIP-seq, ATAC-seq)
- Conventional and affinity biochemistry
- Recombinant protein expression (E. coli, Insect cell)
- Structural biology (Crystallization, TSA, ITC, Microscale thermophoresis, Alpha Fold)
- Immunology (ELISA, FACS)




