Nos axes de recherche
Toxoplasmose & Hôte-parasite coevolution
Étude des effecteurs secrétés par Toxoplasma et de leur conquête de la cellule hôte
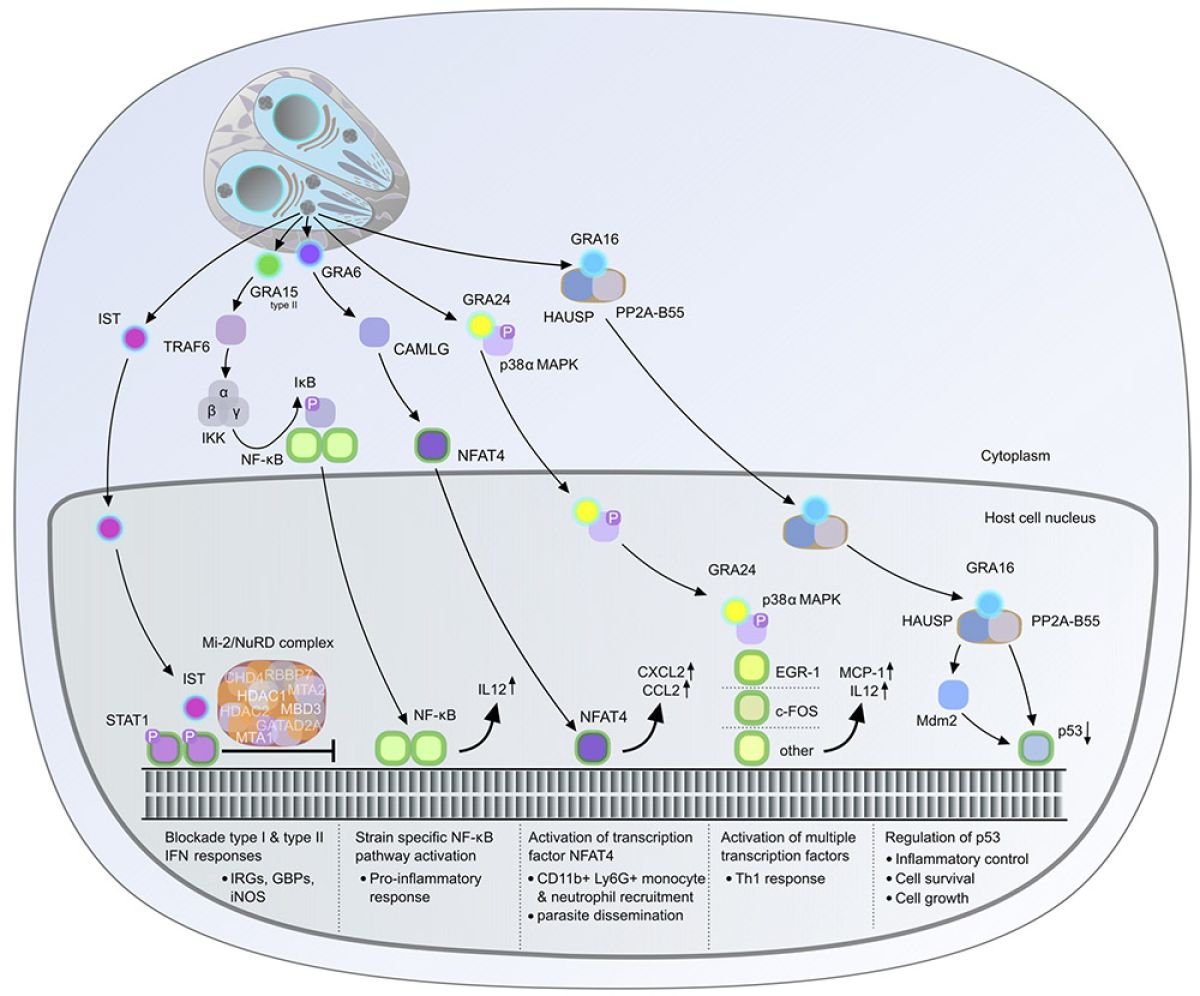
Une caractéristique de l'infection par Toxoplasma est que le parasite détourne activement les voies de signalisation de l'hôte de leurs fonctions originales pour favoriser sa persistance et sa transmission à de multiples hôtes. Notre recherche se concentre sur la manière dont le parasite altère l'expression de gènes hôtes par des modifications réversibles épigénétiques en injectant des protéines effectrices dans les cellules hôtes infectées. La dernière décennie a été une période passionnante pour la recherche sur Toxoplasma, en particulier pour ceux qui s'intéressent à l'interaction entre le pathogène et sa cellule hôte. Nous savons maintenant que le parasite injecte de nombreuses protéines de rhoptrie et de granules denses dans les cellules qu’il infecte, qui jouent des rôles cruciaux dans l'interaction hôte-pathogène. Cette course aux armements entre le parasite et ses hôtes a abouti à une évolution accélérée des protéines effectrices qui contrent et limitent la réponse immunitaire (Hakimi et al., Clin Microbiol Rev. 2017 ; Hakimi, Annual Review of Microbiology, 2022).
Malgré le nombre limité d'effecteurs GRA caractérisés, il est possible de tirer des conclusions générales sur leur modus operandi (Fig. 1). Ces effecteurs peuvent utiliser au moins trois stratégies alternatives pour manipuler l'expression des gènes hôtes, qui ne sont pas nécessairement mutuellement exclusives : (i) la modulation des voies de signalisation en amont, (ii) le ciblage direct des niveaux/activités des facteurs de transcription hôtes, et/ou (iii) l'altération de l'empaquetage d'histones et de la structure de la chromatine. Bien que les fonctions de certaines protéines GRA aient été élucidées, le rôle d'autres reste encore inconnu. Notre équipe de recherche s'appuie sur nos résultats précédents et vise à :
- Identifier le répertoire complet des effecteurs GRA et quantifier l'étendue de leur impact sur la cellule infectée
- Explorer les effets synergiques et/ou antagonistes des effecteurs GRA sur la régulation des gènes.
- Déterminer leur contribution à l'évasion immunitaire et au parasitisme.
- Acquérir une compréhension plus profonde de la fonction des effecteurs GRA en étudiant leur structure tridimensionnelle lorsqu'ils interagissent avec les protéines de la cellule hôte.
Étude du contrôle épigénétique du cycle de vie de Toxoplasma
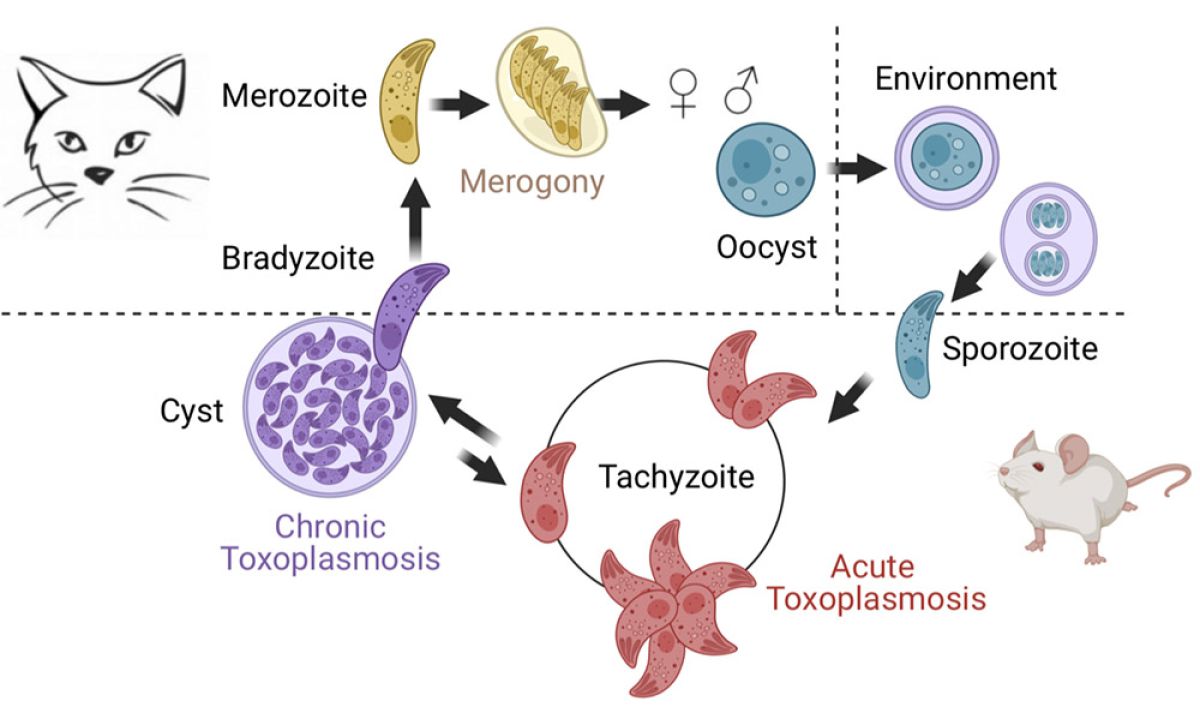
Toxoplasma possède un cycle de vie complexe avec plusieurs étapes et hôtes (Fig. 2). Tous les stades de développement de Toxoplasma ont leur propre signature transcriptionnelle, et le passage d'un stade à l'autre est contrôlé par des cascades de régulation où les mécanismes épigénétiques covalents et non covalents agissent comme des forces motrices. Cet axe de recherche explore ces contributions épigénétiques à l’expression du génome parasitaire qui guident les transitions vers la chronicité et le développement sexuel, voire fixent le zoïte dans un état différencié donné.
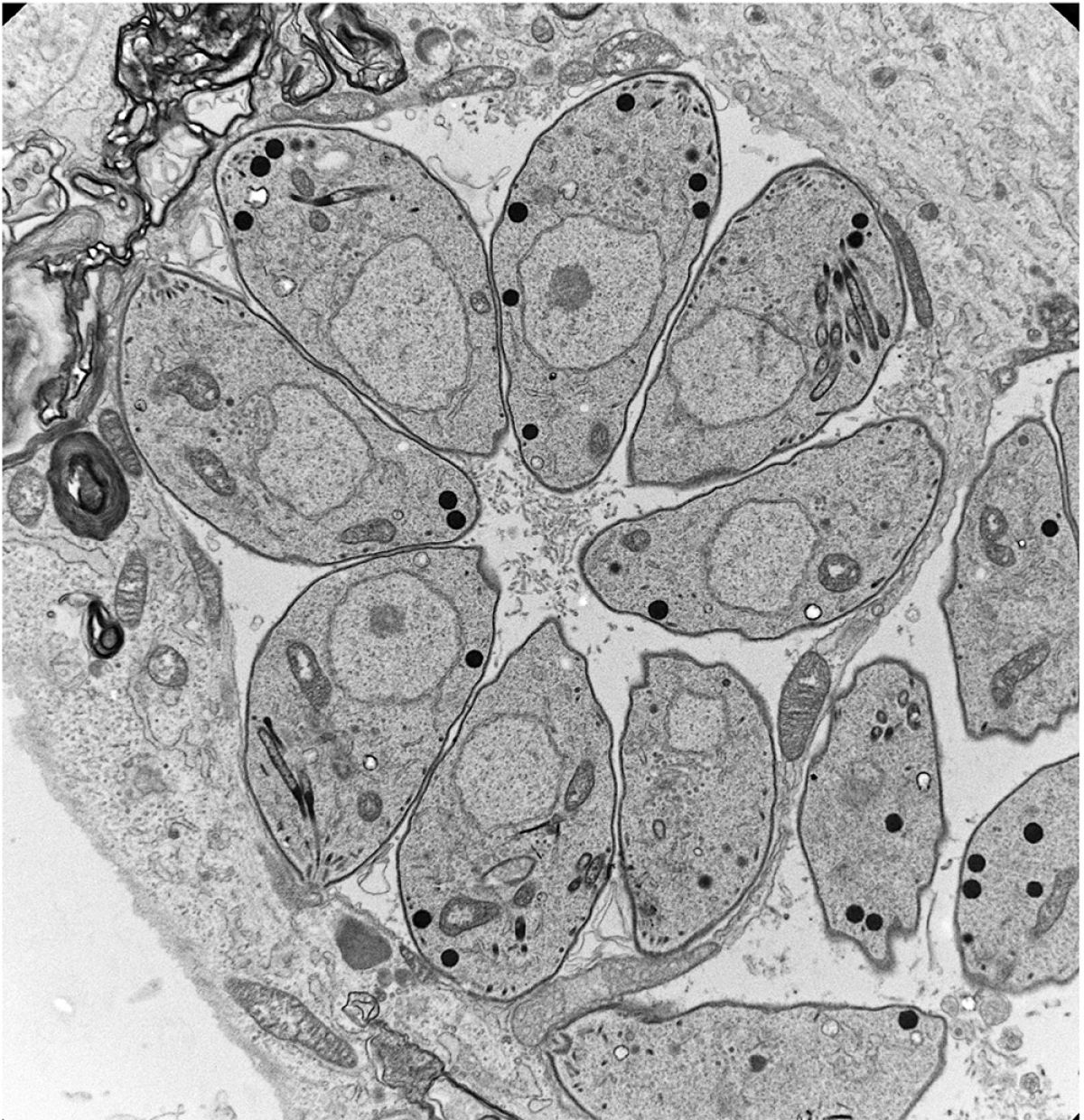
Le défi que nous avons relevé était de reprogrammer les formes sexuelles de Toxoplasma en modifiant le destin cellulaire de sa forme cultivable, le tachyzoïte. Nous avons développé et confirmé un modèle dans lequel plusieurs déterminants épigénétiques régissent les trajectoires de développement du parasite, ainsi que l'unidirectionalité de son cycle de vie hétéroxène. Nous avons identifié une distribution bimodale des marques d'histones au niveau des promoteurs en attente de certains gènes impliqués dans les stades sexuels au sein du tachyzoïte. Nous avons ensuite identifié MORC, un remodeleur chromatinien non conventionnel qui s'associe à l'histone déacétylase HDAC3 pour réprimer l'expression des gènes impliqués dans les stades sexuels. En inactivant génétiquement ces régulateurs (déplétion de la protéine MORC) ou en utilisant des épidrogues (HDACi), nous avons démontré la contribution majeure de ces régulateurs à la différenciation du parasite. Plus récemment, nous avons identifié deux facteurs de transcription, AP2XII-1 et AP2XI-2, qui coopèrent avec MORC/HDAC3 pour contrôler la mérogonie, une étape clé du processus de reproduction sexuelle observée uniquement dans l'intestin du chat jusqu'à présent. En manipulant précisément ces deux commutateurs génétiques, nous avons produit des stades présexuels in vitro, étudié leur transcriptome et leur protéome, et confirmé les résultats des observations faites dans les années 1970 par microscopie électronique en transmission sur des intestins de chats infectés. Nous avons également découvert de nouvelles caractéristiques subcellulaires et décrit en détail le processus unique d'endopolygénie par lequel ces pré-gamètes se divisent.
Notre travail offre une alternative éthique à l'étude de la reproduction sexuelle de Toxoplasma, évitant l'infection des chats. De plus, notre méthode de culture in vitro représente une avancée majeure dans la lutte contre les zoonoses en ouvrant la voie au développement de thérapies innovantes pour bloquer la transmission du parasite des félins à leurs hôtes intermédiaires, y compris l’Homme. Nous testons actuellement des candidats médicaments récemment découverts contre les pré-gamètes produits in vitro.
Repositionner des médicaments pour lutter contre les maladies négligées transmises par les parasites apicomplexes
La toxoplasmose, la cryptosporidiose et le paludisme sont des maladies infectieuses majeures causées par les Apicomplexa, pour lesquelles les traitements actuels sont insuffisants et les options alternatives sont rares. Pour y remédier, nous explorons la diversité chimique des bibliothèques de médicaments hors brevet pour découvrir de nouveaux candidats médicaments pan-Apicomplexa. Notre objectif est de découvrir de nouveaux candidat-médicaments avec un mode d'action alternatif pour nourrir le pipeline des options thérapeutiques antiparasitaires et de passer à la phase de développement préclinique. En menant un criblage de plus de 4 000 candidats médicaments approuvés par la FDA, nous avons identifié de nouveaux composés avec une inhibition à l'échelle nanomolaire de la croissance des espèces de Toxoplasma, Cryptosporidium et Plasmodium, et de hauts indices de sélectivité. Nous prévoyons d'étudier les cibles moléculaires des meilleurs candidats grâce à la chemogénomique, de les valider avec l'édition de génome basée sur CRISPR/Cas9 dans Toxoplasma (Fig. 3), et de comprendre leur mode d'action au niveau atomique en déterminant la structure cristallographique des molécules en complexe avec leurs protéines cibles. Enfin, nous validerons les composés leaders dans des modèles animaux de toxoplasmose et de cryptosporidiose pour démontrer leur potentiel d'utilisation clinique future, tout en renforçant notre compréhension des mécanismes de résistance qui pourraient survenir en raison d'une utilisation généralisée des médicaments chez l’Homme et les animaux.
Développement d'un test sérologique pour détecter le portage des kystes chez les patients infectés
Les maladies chroniques sont devenues un problème de santé publique important et en constante augmentation à l'échelle mondiale, entraînant une hausse des coûts de traitement à long terme et des années de vie ajustées en fonction de l'incapacité (DALY) sur les mesures de santé globales. Cette question concerne des agents infectieux phylogénétiquement non apparentés, tels que des virus, des bactéries, des helminthes et des parasites protozoaires. Parmi ceux-ci, Toxoplasma gondii, un parasite protozoaire, est l'un des micro-organismes les plus répandus sur Terre, capable d'établir un parasitisme à long terme chez tous les métazoaires à sang chaud, y compris les humains. En fait, environ un tiers de la population mondiale est présumée infectée par Toxoplasma. La séroprévalence mondiale varie considérablement selon la région en raison de différents facteurs, tels que le climat, l'alimentation, l'hygiène et la susceptibilité de l'hôte. Bien que la toxoplasmose se présente généralement sous des formes bénignes chez les individus ayant un système immunitaire sain, elle peut provoquer des symptômes graves et potentiellement mortels chez les patients immunodéprimés, en particulier ceux atteints du SIDA ou ayant subi une greffe. Par conséquent, le diagnostic précoce et précis à l'aide de tests de diagnostic sensibles et spécifiques est crucial dans la prévention et le traitement de la toxoplasmose sévère.
Les tests sérologiques ont longtemps été le moyen de confirmation de l'infection à Toxoplasma en première instance, mais le diagnostic sérologique actuel ne distingue pas toujours entre les états de la maladie aiguë, latente et réactivée. Des marqueurs sérologiques spécifiques fiables pour les kystes tissulaires/bradyzoïtes ont fait défaut à la fois pour la recherche et le diagnostic médical. Récemment, notre équipe a fait une percée en découvrant BCLA, un biomarqueur trouvé pour être restreint au stade bradyzoïte, responsable de la toxoplasmose chronique (Dard et al., BMC Biology, 2020). On a constaté que BCLA induisait une forte réponse humorale chez des souris chroniquement infectées et chez des patients humains atteints de différentes formes de toxoplasmose. Notre objectif est d'utiliser ce biomarqueur pour surveiller les niveaux d'anticorps anti-BCLA circulants dans les sérums de i) patients subissant une réactivation sérologique (comme les traitements contre le cancer et les protocoles post-greffe), ii) ceux atteints de toxoplasmose oculaire confirmée, et iii) une cohorte d'individus atteints d'infections congénitales à Toxoplasma. Nous avons également l'intention d'employer le marqueur à base de BCLA pour affiner l'association épidémiologique entre l'infection chronique et les symptômes neuropsychiatriques, en particulier chez les personnes atteintes de schizophrénie et de troubles bipolaires.